- درمان، سیر پیشرفت و پیش آگهی در لوسمی حاد میلوئیدی (AML):
- سوالات متداول
- عوامل خطر برای ایجاد لوسمی حاد میلوئیدی (AML) شامل چه مواردی است؟
- روش های تشخیصی لوسمی حاد میلوئیدی (AML) شامل چه مواردی است؟
- لوسمی حاد میلوئیدی (AML) چه تفاوتی با لوسمی لنفوبلاستیک حاد (ALL) دارد؟
- اثرات طولانی مدت درمان لوسمی حاد میلوئیدی (AML) بر افرادی که زنده می مانند چیست؟
- لوسمی حاد میلوئیدی (AML) چگونه برسیستم عصبی مرکزی (CNS) تاثیر می گذارد؟
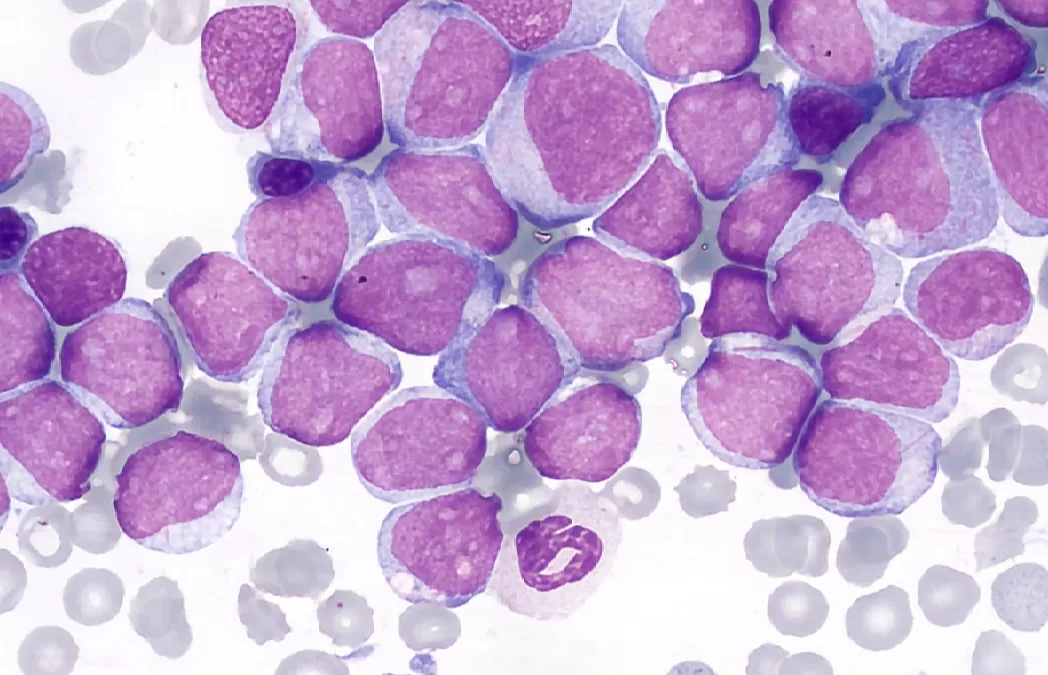
لوسمی حاد میلوئیدی (AML) | لوسمی میلوژن حاد | Acute Myelogenous Leukemia | Acute myeloid leukemia | سرطان خون AML
- لوسمی حاد میلوئیدی (AML) یک بدخیمی است که منشا آن سلول های بنیادی لنفو خونساز یا یک سلول خونساز چند پتانسیل نزدیک است.
- لوسمی حاد میلوئیدی (AML) با تکثیر کلونال سلول های بلاست لوسمیک در مغز و اختلال در تولید سلول های خونی طبیعی مشخص می شود که منجر به کم خونی می شود. شامل ترومبوسیتوپنی؛ و تعداد گلبول های سفید کم، طبیعی یا زیاد بسته به غلظت سلول های لوسمیک در خون.
- AML در 9 نوع مورفولوژیک (فنوتیپی) رخ می دهد که هر کدام دارای ویژگی های سیتولوژیک، ژنتیکی و گاهی بالینی هستند.
- مشخص شده است که تعداد بیشماری (بیش از 150) محرک ژنتیکی جهش یافته و انکوژن های همکار دارد.
لوسمی حاد میلوئیدی (AML) چیست؟
لوسمی حاد میلوئیدی (AML) نوعی سرطان است که بر مغز استخوان و خون تأثیر می گذارد. منشأ آن از سلول های میلوئیدی است که مسئول تولید گلبول های قرمز، گلبول های سفید و پلاکت ها هستند. در AML، سلولهای میلوئید غیرطبیعی میشوند و به سرعت تکثیر میشوند و سلولهای طبیعی در مغز استخوان را از بین میبرند.
AML معمولاً از طریق آزمایش خون، آسپیراسیون مغز استخوان و بیوپسی و مطالعات تصویربرداری تشخیص داده می شود. گزینه های درمانی برای AML ممکن است شامل شیمی درمانی، درمان هدفمند، پیوند سلول های بنیادی و مراقبت های حمایتی برای مدیریت علائم و عوارض باشد.
پیش آگهی AML به عواملی مانند سن بیمار، سلامت کلی، ناهنجاری های ژنتیکی خاص در سلول های لوسمی و پاسخ به درمان بستگی دارد. تشخیص زودهنگام و درمان مناسب برای بهبود نتایج در بیماران AML حیاتی است.
اپیدمیولوژی لوسمی حاد میلوئیدی (AML):
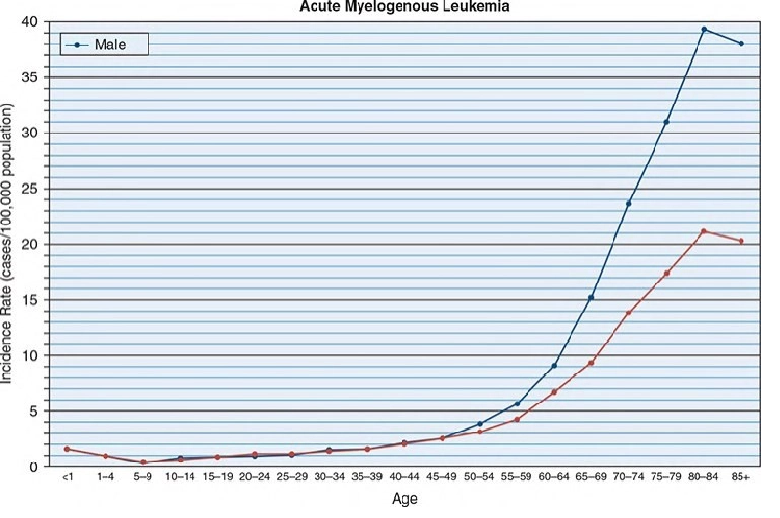
- لوسمی حاد میلوئیدی (AML) عامل 80 درصد لوسمی های حاد در بزرگسالان و 15 تا 20 درصد در کودکان است.
- لوسمی حاد میلوئیدی (AML) شایع ترین لوسمی در نوزادان است. این منجر به یک منحنی بروز دووجهی با حداکثر در سن کمتر از 1 سالگی تقریباً 2 مورد در هر 100000 نوزاد می شود که در سن 7 سالگی به تقریباً 0.4 مورد در هر 100000 کاهش می یابد و سپس تا سن 25 سالگی به 1.0 در هر 100000 افزایش می یابد. پس از آن، بروز به طور تصاعدی به 20 مورد در هر 100000 نفر در هشت سالگی افزایش می یابد.
- یک استثنا برای تغییر قابل توجه در بروز با افزایش سن در بزرگسالان در APL یافت می شود که در آن بروز بر اساس سن به میزان قابل توجهی تغییر نمی کند.
- چهار مواجهه به عنوان عوامل مسبب ایجاد شده است. این موارد شامل تشعشع با دوز بالا است. قرار گرفتن در معرض بنزن مزمن با دوز بالاتر، معمولاً در یک محیط صنعتی. درمان سایر سرطانها یا سندرمهای خودایمنی شدید با عوامل آلکیلهکننده، مهارکنندههای توپوایزومراز II، مشتقات پلاتین یا برخی داروهای سیتوتوکسیک دیگر. و سیگار کشیدن طولانی مدت چاقی با افزایش خطر نئوپلاسم همراه است. بسیاری از عوامل محیطی احتمالی دیگر مورد مطالعه قرار گرفتهاند، اما بهعنوان عوامل علی ثابت نشدهاند.
- خطر ابتلا به لوسمی حاد میلوئیدی (AML) در یک خواهر یا برادر غیر همسان تقریباً 2.5 برابر افراد غیر مرتبط زیر 15 سال در افراد اروپایی تبار است.
- خطر ابتلا به لوسمی حاد میلوئیدی (AML) در یهودیان اروپای شرقی افزایش یافته است و نوع APL در میان لاتین تبارها افزایش یافته است.
ویژگی های بالینی لوسمی حاد میلوئیدی (AML):
- علائم و نشانه های تظاهرکننده مکرر علائم و نشانه هایی هستند که منعکس کننده کم خونی (رنگ پریدگی، خستگی، ضعف، تپش قلب و تنگی نفس در هنگام فعالیت) یا ترومبوسیتوپنی (اکیموز، پتشی، اپیستاکسی، خونریزی لثه، خونریزی ملتحمه، و خونریزی طولانی مدت پس از بریدگی های جزئی) هستند.
- عفونت های پیوژنیک جزئی پوست شایع هستند. عفونتهای عمده در هنگام تشخیص، قبل از درمان سیتوتوکسیک غیرمعمول هستند.
بی اشتهایی و کاهش وزن ممکن است رخ دهد. - تب با درجه پایین ممکن است در شروع وجود داشته باشد.
- طحال یا هپاتومگالی خفیف در حدود یک سوم بیماران وجود دارد. بزرگ شدن غدد لنفاوی غیر معمول است، به جز با نوع مونوسیتی.
- سلول های لوسمیک ممکن است به هر عضوی در بدن نفوذ کنند، اما در نتیجه اختلال عملکرد اندام غیرعادی است.
- گاهی اوقات، تجمع بزرگ میلوبلاست ها (سارکوم میلوئید) ممکن است تقریباً در هر بافتی ایجاد شود.
- مونوبلاست ها و پرومونوسیت های لوسمیک اغلب به بافت ها نفوذ می کنند و این محل ها می توانند علامت دار باشند (مانند لوسمی کوتیس، هیپرپلازی لثه، لنفادنوپاتی و موارد دیگر).
- لوسمی حاد میلوئیدی (AML) می تواند باعث انبساط و نفوذ مغز استخوان شود و منجر به درد استخوان، به ویژه در استخوان های بلند (مانند پاها و بازوها) شود.
- لوسمی حاد میلوئیدی (AML) می تواند منجر به کاهش تعداد گلبول های قرمز خون و کم خونی و در نتیجه علائمی مانند تنگی نفس، به ویژه در هنگام فعالیت بدنی شود.
- در موارد نادر، AML ممکن است باعث علائم عصبی مانند سردرد، سرگیجه، اختلالات بینایی یا نقص عصبی ناشی از نفوذ لوسمی در سیستم عصبی مرکزی (CNS) شود.
- بسته به نوع خاص و میزان درگیری لوسمی حاد میلوئیدی (AML)، بیماران ممکن است علائم دیگری مانند بثورات پوستی (لوسمی کوتیس)، درد شکم، درد مفاصل و تورم غدد لنفاوی را تجربه کنند.
درمان، سیر پیشرفت و پیش آگهی در لوسمی حاد میلوئیدی (AML):
درمان، سیر پیشرفت و پیش آگهی در لوسمی میلوئید حاد (AML) به عوامل مختلفی از جمله سن بیمار، سیتوژنتیک، ژنتیک مولکولی، پاسخ به درمان اولیه و وضعیت سلامت کلی بستگی دارد:
گزینه های درمانی لوسمی حاد میلوئیدی (AML):
- شیمی درمانی: پایه اصلی درمان لوسمی حاد میلوئیدی (AML) شیمی درمانی القایی است که معمولاً از سیتارابین و یک آنتراسایکلین (مانند دانوروبیسین یا ایداروبیسین) تشکیل شده است. هدف از این کار القای بهبودی با از بین بردن سلول های لوسمی از مغز استخوان است.
- پیوند سلول های بنیادی (SCT): برای بیماران واجد شرایط، به ویژه بیماران مبتلا به AML پرخطر یا عود کننده/ مقاوم به درمان، SCT (آلوژنیک یا اتولوگ) ممکن است پس از بهبودی برای تثبیت پاسخ و جلوگیری از عود در نظر گرفته شود.
- درمان های هدفمند: عوامل جدیدتر که ناهنجاری های مولکولی خاص را در AML هدف قرار می دهند، مانند مهارکننده های FLT3 (مانند میدوستاورین، gilteritinib)، مهارکننده های IDH (مانند ivosidenib، enasidenib)، و سایر موارد، در موارد خاص، به ویژه relaps استفاده می شود. AML / مقاوم به درمان یا آنهایی که دارای جهش های خاص هستند.
سیر پیشرفت بیماری لوسمی حاد میلوئیدی (AML):
- فاز القایی: بیماران برای دستیابی به بهبودی کامل (CR) تحت شیمی درمانی القایی قرار می گیرند که با بلاست های کمتر از 5 درصد در مغز استخوان، بهبود شمارش خون و عدم وجود بیماری خارج مدولاری تعریف می شود.
- فاز تثبیت: پس از CR، بیماران ممکن است درمان تثبیت کننده را دریافت کنند که هدف آن حذف سلول های لوسمیک باقیمانده و جلوگیری از عود است. این ممکن است شامل چرخه های شیمی درمانی اضافی یا SCT باشد.
- درمان نگهدارنده: برخی از بیماران ممکن است درمان نگهدارنده را، به ویژه در محیط های کارآزمایی بالینی، برای طولانی کردن بهبودی و کاهش خطر عود دریافت کنند.
پیش آگهی لوسمی حاد میلوئیدی (AML):
- عوامل پیش آگهی مطلوب: بیماران با سیتوژنتیک مطلوب (به عنوان مثال، t(8;21)، inv(16))، جهش NPM1 بدون FLT3-ITD، و سن کمتر (به ویژه کمتر از 60 سال) نتایج بهتری دارند. و شانس بیشتری برای دستیابی به بهبودی طولانی مدت.
- عوامل پیش آگهی نامطلوب: سیتوژنتیک نامطلوب (به عنوان مثال، کاریوتیپ پیچیده، -5/del(5q)، -7/del(7q))، نسبت آللی بالای FLT3-ITD، جهش های TP53، سن بالاتر و بیماری های همراه عبارتند از همراه با پیامدهای ضعیف تر و نرخ عود بالاتر.
- پاسخ به درمان: پاسخ زودهنگام به شیمی درمانی القایی (به عنوان مثال، دستیابی به CR پس از یک سیکل) یک شاخص پیش آگهی مثبت است. برعکس، بیماری مقاوم به درمان یا عود پس از درمان اولیه نشان دهنده پیش آگهی ضعیف تری است و ممکن است به رویکردهای درمانی جایگزین نیاز داشته باشد.
- حداقل بیماری باقیمانده (MRD): ارزیابی MRD، با استفاده از تکنیک هایی مانند فلوسیتومتری یا آزمایش مولکولی، اطلاعات پیش آگهی ارزشمندی را ارائه می دهد و به تصمیم گیری های درمانی پس از بهبودی کمک می کند.
سوالات متداول
عوامل خطر برای ایجاد لوسمی حاد میلوئیدی (AML) شامل چه مواردی است؟
- سن: لوسمی حاد میلوئیدی (AML) در افراد مسن شایع تر است و بیشترین بروز آن در افراد بالای 65 سال است.
- شیمی درمانی یا پرتودرمانی قبلی: قرار گرفتن در معرض داروهای شیمی درمانی خاص (مانند عوامل آلکیله کننده، مهارکننده های توپوایزومراز II) یا پرتودرمانی برای سرطان های قبلی خطر ابتلا به AML ثانویه (sAML) را افزایش می دهد.
- سندرم های ژنتیکی: سندرم های ژنتیکی ارثی مانند سندرم داون، سندرم Li-Fraumeni، کم خونی فانکونی و غیره با افزایش خطر ابتلا به AML مرتبط هستند.
- سندرم های میلودیسپلاستیک (MDS): بیماران مبتلا به MDS، اختلالی که با تولید غیرطبیعی سلول های خونی مشخص می شود، خطر پیشرفت به لوسمی حاد میلوئیدی (AML) افزایش می یابد.
- قرار گرفتن در معرض بنزن: مواجهه شغلی با بنزن، یک ماده شیمیایی که در صنایعی مانند پالایش نفت، تولید لاستیک و تولید مواد شیمیایی یافت می شود، یک عامل خطر شناخته شده برای لوسمی حاد میلوئیدی (AML) است.
- جهش های ژنتیکی خاص: جهش های ژنتیکی خاص، مانند جهش در ژن هایی مانند RUNX1، CEBPA و غیره، با افزایش خطر ابتلا به AML مرتبط هستند.
روش های تشخیصی لوسمی حاد میلوئیدی (AML) شامل چه مواردی است؟
روشهای تشخیصی لوسمی حاد میلوئیدی (AML) شامل ترکیبی از ارزیابی بالینی، تست های آزمایشگاهی، مطالعات تصویربرداری و بررسی مغز استخوان است. در اینجا روش های اصلی تشخیصی مورد استفاده برای AML آمده است:
ارزیابی بالینی:
- تاریخچه پزشکی کامل شامل علائمی مانند خستگی، تب، کبودی یا خونریزی آسان، عفونت های مکرر، درد استخوان و بزرگ شدن غدد لنفاوی یا طحال به دست می آید.
- معاینه فیزیکی برای ارزیابی علائم لوسمی مانند رنگ پریدگی، پتشی، هپاتواسپلنومگالی و لنفادنوپاتی انجام می شود.
تست های آزمایشگاهی:
- شمارش کامل خون (CBC): CBC با افتراقی برای تشخیص ناهنجاری هایی مانند کم خونی (تعداد کم گلبول های قرمز خون)، لکوپنی یا نوتروپنی (تعداد کم گلبول های سفید خون) و ترومبوسیتوپنی (تعداد کم پلاکت ها) ضروری است. که در لوسمی حاد میلوئیدی (AML) رایج هستند.
- اسمیر خون محیطی: معاینه خون محیطی در زیر میکروسکوپ ممکن است وجود سلول های بلاست غیرطبیعی، میله های اور (در صورت وجود) و سایر ویژگی های سیتولوژیکی را نشان دهد که نشان دهنده AML هستند.
- تست های بیوشیمیایی: این تست ها عملکرد اندام ها، از جمله تست های عملکرد کبد، تست های عملکرد کلیوی، سطح الکترولیت ها و سطوح لاکتات دهیدروژناز (LDH) را ارزیابی می کنند. ناهنجاری ها ممکن است نشان دهنده درگیری اندام یا عوارض لوسمی حاد میلوئیدی (AML) باشد.
آسپیراسیون و بیوپسی مغز استخوان:
بررسی مغز استخوان برای تشخیص AML و ارزیابی میزان بیماری ضروری است. شامل:
- آسپیراسیون: نمونه ای از مایع مغز استخوان با استفاده از سوزن آسپیره می شود و از نظر مورفولوژی سلولی شامل درصد بلاست ها بررسی می شود.
- بیوپسی: بیوپسی از مغز استخوان برای ارزیابی سلولی بودن، معماری و وجود فیبروز یا نفوذ سلول های لوسمیک گرفته می شود.
- تحلیل سیتوژنتیک: تجزیه و تحلیل کروموزومی سلول های مغز استخوان ناهنجاری های سیتوژنتیکی مانند جابه جایی ها، وارونگی ها و حذف ها را که برای طبقه بندی و پیش آگهی لوسمی حاد میلوئیدی (AML) مهم هستند، شناسایی می کند.
- آزمایش مولکولی: تجزیه و تحلیل مولکولی جهش های ژنی خاص و بازآرایی های مرتبط با زیرگروه های لوسمی حاد میلوئیدی (AML) را شناسایی می کند، از جمله جهش در ژن هایی مانند FLT3، NPM1، CEBPA، و غیره. این تستها به طبقهبندی زیرگروه، طبقهبندی خطر و انتخاب درمان هدفمند کمک میکنند.
مطالعات تصویربرداری:
- اشعه ایکس قفسه سینه: برای ارزیابی توده های مدیاستن یا ارتشاح.
- توموگرافی کامپیوتری (CT) اسکن: به ارزیابی بزرگ شدن غدد لنفاوی، درگیری اندام ها و وجود بیماری خارج مدولاری کمک می کند.
- تصویربرداری تشدید مغناطیسی (MRI): ممکن است برای ارزیابی CNS در صورت وجود علائم عصبی یا مشکوک به درگیری CNS استفاده شود.
فلوسایتومتری:
- ایمونوفنوتایپینگ مغز استخوان یا نمونه های خون محیطی با استفاده از فلوسیتومتری به شناسایی سلول های لوسمیک بر اساس نشانگرهای سطح سلولی (مارکرهای CD) کمک می کند و به طبقه بندی زیرگروه و تمایز از سایر اختلالات هماتولوژیک کمک می کند.
لوسمی حاد میلوئیدی (AML) چه تفاوتی با لوسمی لنفوبلاستیک حاد (ALL) دارد؟
- لوسمی حاد میلوئیدی (AML) از تکثیر غیرطبیعی سلول های میلوئیدی در مغز استخوان ناشی می شود که منجر به تجمع بلاست های میلوئید نابالغ می شود.
- از طرف دیگر، ALL از تکثیر غیرطبیعی سلول های لنفاوی منشأ می گیرد که منجر به افزایش لنفوبلاست های نابالغ می شود.
- از نظر مورفولوژیکی، بلاست های لوسمی حاد میلوئیدی (AML) نشانگرهای دودمان میلوئیدی را نشان می دهند (مانند CD13، CD33)، در حالی که ALL بلاست ها نشانگرهای لنفوئیدی را نشان می دهند (مانند CD19، CD20).
- تفاوت های سیتوژنتیکی و مولکولی نیز بین AML و ALL وجود دارد، با ناهنجاری های ژنتیکی مشخص مرتبط با هر بیماری.
اثرات طولانی مدت درمان لوسمی حاد میلوئیدی (AML) بر افرادی که زنده می مانند چیست؟
بازماندگان طولانی مدت لوسمی حاد میلوئیدی (AML) ممکن است اثرات دیررس مختلفی را در ارتباط با درمان تجربه کنند، از جمله:
- سرطان های ثانویه: برخی از عوامل شیمی درمانی و پرتودرمانی می توانند خطر ابتلا به سرطان های ثانویه را در مراحل بعدی زندگی افزایش دهند.
- عوارض قلبی عروقی: برخی درمان ها ممکن است منجر به مشکلات قلبی مانند کاردیومیوپاتی، آریتمی و بیماری های عروقی شود.
- اختلالات غدد درون ریز: عدم تعادل هورمونی، اختلال عملکرد تیروئید و نارسایی غدد جنسی ممکن است به دلیل اثرات درمانی رخ دهد.
- اختلال عصبی شناختی: نقص شناختی، مشکلات حافظه و نوروپاتی ممکن است در نتیجه سمیت عصبی مرتبط با درمان باشد.
- مسائل باروری: درمان ممکن است بر باروری تأثیر بگذارد و منجر به ناباروری یا چالش های باروری در بازماندگان شود.
مراقبت طولانی مدت پیگیری برای نظارت و مدیریت این اثرات دیررس احتمالی در بازماندگان AML ضروری است.
لوسمی حاد میلوئیدی (AML) چگونه برسیستم عصبی مرکزی (CNS) تاثیر می گذارد؟
- لوسمی حاد میلوئیدی (AML) می تواند سیستم عصبی مرکزی (CNS) را از طریق نفوذ سلول های لوسمیک به مغز و نخاع درگیر کند.
- درگیری CNS ممکن است منجر به علائم عصبی مانند سردرد، تشنج، فلج عصب جمجمه و تغییر وضعیت ذهنی شود.
- تشخیص لوسمی CNS با تجزیه و تحلیل مایع مغزی نخاعی (CSF) تایید می شود که ممکن است افزایش بلاست یا سیتولوژی غیرطبیعی را نشان دهد.
- درمان لوسمی CNS ممکن است شامل شیمی درمانی داخل نخاعی، درمان سیستمیک یا تابش جمجمه برای کنترل گسترش بیماری به CNS باشد.
در ادامه خواهید خواند...
- درمان، سیر پیشرفت و پیش آگهی در لوسمی حاد میلوئیدی (AML):
- سوالات متداول
- عوامل خطر برای ایجاد لوسمی حاد میلوئیدی (AML) شامل چه مواردی است؟
- روش های تشخیصی لوسمی حاد میلوئیدی (AML) شامل چه مواردی است؟
- لوسمی حاد میلوئیدی (AML) چه تفاوتی با لوسمی لنفوبلاستیک حاد (ALL) دارد؟
- اثرات طولانی مدت درمان لوسمی حاد میلوئیدی (AML) بر افرادی که زنده می مانند چیست؟
- لوسمی حاد میلوئیدی (AML) چگونه برسیستم عصبی مرکزی (CNS) تاثیر می گذارد؟